Misją Instytutu jest dzialalność naukowo-badawcza prowadząca do nowych rozwiązań technicznych i organizacyjnych użytecznych w kształtowaniu warunków pracy zgodnych z zasadami bezpieczeństwa pracy i ergonomii oraz ustalanie podstaw naukowych do właściwego ukierunkowywania polityki społeczno-ekonomicznej państwa w tym zakresie.
Wyszukiwanie w bazie wiedzy
Do wyznaczenia stężenia i składu gatunkowego mikroorganizmów w próbkach mikrobiologicznych stosowane są metody mikroskopowe, hodowlane, metaboliczne i molekularne.
Metody mikroskopowe
Metody mikroskopowe polegają na bezpośrednim szacowaniu, w odpowiednio przygotowanych preparatach, liczby drobnoustrojów (np. spor grzybów) lub innych struktur biologicznych oraz obliczeniu ich zawartości w jednostce objętości powietrza. Próbki powietrza pobierane są zwykle na szkiełko mikroskopowe podstawowe lub inne powierzchnie pokryte lepką substancją (np. wazeliną, mieszaniną żelatyny i gliceryny. Zaletą metod mikroskopowych jest rejestrowanie wszystkich mikroorganizmów tj. żywych i martwych, natomiast wadą brak możliwości precyzyjnej identyfikacji gatunkowej mikroflory, szczególnie bakterii.
Metody hodowlane
Metody hodowlane pozwalają określić liczbę żywych i zdolnych do rozwoju drobnoustrojów w badanej objętości powietrza. Zgodnie z normą PN-EN 13098:2020-01, do hodowli różnych gatunków bakterii zaleca się stosowanie podłoża bogatego w składniki odżywcze, np. agaru odżywczego, agaru tryptonowo-glukozowego, pożywki agarowej z hydrolizatem kazeinowo-sojowym. W celu zahamowania wzrostu grzybów na wymienionych podłożach norma zaleca dodawanie odpowiednich antybiotyków, np. cykloheksymidu. Do hodowli, namnażania i oznaczania ilościowego grzybów zgodnie z wyżej wymienioną normą jest polecany agar z ekstraktem maltozowym, agar z glicerolem i dichloranem z dodatkiem antybiotyków o szerokim spektrum działania hamujących wzrost bakterii. Ważnym elementem w metodzie hodowlanej jest temperatura i czas inkubacji. Najczęściej zaleca się temperaturę 30–37°C dla bakterii oraz 20–27°C dla grzybów. Czas hodowli to zwykle 24–48 godzin dla bakterii oraz 5–7 dni dla grzybów.
Wynik pomiaru stężenia bioaerozolu wyraża się w jednostkach tworzących kolonie w 1 metrze sześciennym powietrza (jtk/m3). Jednostka „jtk” oznacza liczbę komórek lub agregatów komórek drobnoustrojowych zdolnych do wzrostu na odpowiedniej pożywce agarowej w postaci oddzielnych kolonii. Metody hodowlane umożliwiają identyfikację izolowanych drobnoustrojów do szczebla rodzaju lub gatunku.
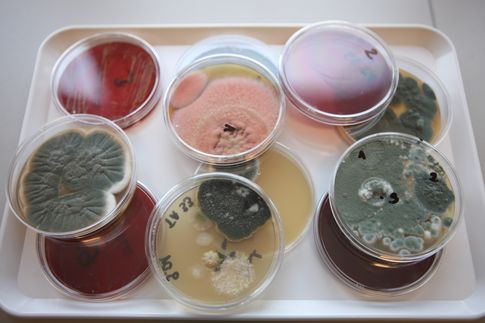
Kolonie bakterii i grzybów na podłożach mikrobiologicznych
Metody metaboliczne i molekularne
W metodach metabolicznych i molekularnych, stężenie mikroorganizmów w powietrzu wyznaczane jest na podstawie wykrycia obecności produktów ich metabolizmu lub materiału genetycznego drobnoustrojów. Metody te wykorzystywane są m.in. do oznaczania w powietrzu stężenia: ergosterolu, endotoksyn, mikotoksyn, glukanów i kwasów tłuszczowych. W zależności od charakteru badanego czynnika stosuje się odpowiednie techniki analityczne np. wysokosprawną chromatografię cieczową (HPLC), gazowo-cieczową (GLC), cienkowarstwową (TLC) czy spektrofotometrię UV. Metody metaboliczne oceniające zdolność mikroorganizmów do enzymatycznego rozkładu organicznych substratów (np. szereg biochemiczny API) lub analizujące metabolizm mikroorganizmów w odniesieniu do specyficznych źródeł węgla (np. system Biolog) znalazły zastosowanie w identyfikacji bakterii i grzybów. Bardzo często korzysta się z metod immunologicznych, opartych o stosowanie przeciwciał monoklonalnych, poliklonalnych czy markerów immunologicznych, które ujawniają obecność określonych grup lub szczepów drobnoustrojów. Wykorzystywane są również techniki biologii molekularnej z użyciem komplementarnych sond fluorescencyjnych identyfikujących gen 16S rRNA, reakcji łańcuchowej polimerazy (PCR), które umożliwiają identyfikację pojedynczych gatunków mikroorganizmów, mikromacierzy DNA.
Metody molekularne mają istotna przewagę nad tradycyjnymi technikami, gdyż nie są uzależnione od hodowli mikroorganizmów na podłożach mikrobiologicznych. Pozwala to na zdecydowane przyśpieszenie procedury badawczej. Metody oparte na analizie materiału genetycznego charakteryzują się dużą czułością, powtarzalnością i bezpieczeństwem.

Szereg biochemiczny API
Metodyka oznaczania stężenia endotoksyny bakteryjnej w powietrzu
Endotoksynę oznacza się powszechnie testem Limulus, w którym wykorzystuje się wywołane reakcją enzymatyczną zjawisko koagulacji krwi prymitywnego stawonoga morskiego skrzypłocza (Limulus polyphemus)w obecności minimalnych (rzędu 10-12 grama) ilości endotoksyny. W najprostszej wersji testu, próbkę powietrza pobraną na filtr membranowy poddaje się ekstrakcji w apirogennej wodzie destylowanej, a następnie sporządza się szereg rozcieńczeń, który inkubuje się w łaźni wodnej z komercyjnie dostępnym odczynnikiem Limulus (jest to zliofilizowany lizat amebocytów skrzypłocza). Wytworzenie się skrzepu, który nie spływa po odwróceniu próbówki, jest dodatnim wynikiem testu. Po odczytaniu testu, za pomocą wzoru podanego przez producenta, oblicza się stężenie endotoksyny w aerogennym pyle i w powietrzu. Test Limulus wykonuje się obecnie w różnych modyfikacjach, zwiększających czułość i powtarzalność metody. W większości są one oparte na spektrofotometrycznym odczycie barwnej reakcji enzymatycznej. Najbardziej wiarygodne wyniki daje metoda kinetyczna, w której rejestrowana jest szybkość biegu reakcji enzymatycznej w ciągu określonego czasu, a wynik oznaczenia uzyskuje się na podstawie komputerowej analizy prędkości tych zmian. W opisanym powyżej teście dokonuje się pomiaru stężenia tylko tej endotoksyny, która jest aktywna w teście Limulus. Alternatywną dla testu Limulus metodą mierzącą stężenie całkowite endotoksyny bakteryjnej w powietrzu jest metoda polegająca na skojarzonym zastosowaniu chromatografii gazowej i spektrometrii masowej (GC-MS) do oznaczania 3-hydroksylowanych kwasów tłuszczowych, wchodzących w skład cząsteczki endotoksyny i uznawanych za jej chemiczne markery. Jest to metoda droższa, ale dająca wiarygodne wyniki i co równie ważne, pozwalająca nie tylko na oznaczanie ilościowe, ale również na charakterystykę jakościową endotoksyny.
Metodyka oznaczania innych toksycznych substancji mikrobiologicznych w powietrzu
Peptydoglikany
Stężenie peptydoglikanu określa się na podstawie oznaczenia kwasu muraminowego metodą chromatografii gazowej i spektrometrii masowej (GC-MS) lub testem enzymatycznym przy wykorzystaniu jako substratu plazmy larwy jedwabnika (Silkworm Larvae Plasma test, SLP).
(1→3)-β-D-glukany
(1→3)-β-D-glukany grzybicze oznacza się obecnie albo za pomocą zmodyfikowanego testu enzymatycznego Limulus służącego do wykrywania endotoksyn bakteryjnych, albo testem SLP, albo też przy zastosowaniu immunotestu (Inhibition Enzyme Immunoassay – EIA).
Mikotoksyny lub mikrobiologiczne lotne związki organiczne (MLZO)
Próbki powietrza służące do oznaczania mikotoksyn lub mikrobiologicznych lotnych związków organicznych pobiera się do pochłaniacza płynnego lub stałego (sorber węglowy lub filtr), a następnie oznacza metodami chromatograficznymi.
Metodyka oznaczania stężenia swoistych alergenów w powietrzu
Stężenie swoistych alergenów roślinnych i zwierzęcych w powietrzu określa się stosując metody immunologiczne. Schemat postępowania w tego typu badaniach obejmuje następujące etapy: a) przygotowanie surowic odpornościowych (np. chorych pracowników), skierowanych przeciw alergenom, które chcemy wykryć; b) pobranie próbek powietrza na stanowisku roboczym (najkorzystniej na filtr lub do cieczy) w celu oznaczenia zawartego w nim alergenu; c) wykonanie testu immunologicznego, określającego, na podstawie intensywności reakcji przeciwciała z alergenem (użytym w formie zagęszczonego przesączu lub ekstraktu z filtru), jego stężenie w powietrzu. Najczęściej używa się do tego celu testu inhibicji radioimmunoabsorpcji RAST lub testu immunoenzymatycznego ELISA. Metody określania stężenia swoistych alergenów w powietrzu środowiska pracy, chociaż obecnie jeszcze dość drogie i skomplikowane, mają w przyszłości szansę na upowszechnienie z uwagi na ich wartość w prognozowaniu ryzyka alergii zawodowej w konkretnej grupie pracowników.


